In dieser ersten Sendung zur Atomphysik wird eine Vorstellung vom Aufbau eines Atoms gegeben. Der Begriff "Atom" stammt zwar aus der griechischen Antike und bedeutet etwas "Unteilbares", die heute verwendeten Atommodelle wurden jedoch erst Ende des 19. Jahrhunderts von Chemikern und dann bis Anfang des 20. Jahrhunderts von Physikern entwickelt. Die Sendung gliedert sich in folgende Abschnitte:
Bei Atom - und Kernphysik denken viele Menschen sofort an Atombomben oder Kernkraftwerke. Letztere liefern einerseits einen bedeutenden
Beitrag zu unserer Energieversorgung, andererseits ist diese Energieart sehr
umstritten, weil sie seit dem Reaktorunfall von Tschernobyl als gefährlich
erachtet wird. Insbesondere ist die Lagerung radioaktiver Abfälle schwierig und die Frage der
Endlagerung noch nicht abschließend geklärt. Für die Zukunft erhoffen sich
Wissenschaftler eine Nutzung von Kernenergie wie auf der Sonne. Denn durch die Fusion leichterer Kerne wird ebenfalls
eine gewaltige Energie zur Verfügung gestellt. Neben der Energienutzung hat die
Atom- und Kernphysik bedeutende Verbesserungen im Bereich der Medizin gebracht,
man denke nur an Röntgengeräte und die Bekämpfung von Tumoren durch radioaktive
Präparate.
Der Begriff "Atom" wird heute dem griechischen Gelehrten Demokrit zugeschrieben. Das griechische Wort "atomos" bedeutet
"unteilbar". Es gab also schon in der Antike die Vorstellung, dass jede Materie
aus unteilbaren Grundbausteinen zusammengesetzt ist. Diese Urvorstellung rückte
mit dem Aufschwung der Chemie ab dem 18. Jahrhundert in den Mittelpunkt der
Forschung und gipfelte unter dem berühmten Chemiker Dalton im Periodensystem der
Atome. Heute ist es für uns selbstverständlich, dass wir uns ein Molekül als Verbindung von kugelförmigen Atomen vorstellen.
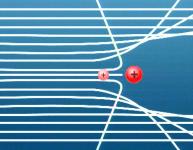
Die Atomforschung der Physiker hatte als Ausgangspunkt die Erkenntnis, dass
in den Atomen positive und negative Ladungen vorhanden sein müssen. Beim
Experiment mit der Gasentladungsröhre wird in stark verdünnter Luft durch
Hochspannung ein Stromfluss in Gang gesetzt. Dabei stoßen elektrische Ladungen
an Luftatome und regen diese zum Leuchten an. Der Nachweis der elektrischen
Ladungen erfolgt mit Hilfe eines Hufeisenmagneten, denn das Gas lässt sich
ablenken. Der Physiker Joseph J. Thomson entwickelte in der Folge ein
Atommodell, bei dem in einem positiv geladenen Atom gleichmäßig Elektronen
eingebettet sind; man nennt es liebevoll Thomson'sches "Rosinenkuchenmodell". Bei einem neutralen Atom kompensieren
sich nach außen hin beide Ladungssorten, bei einem Ion gibt es
Elektronenüberschuss oder Elektronenmangel. Das Rosinenkuchenmodell wurde bald
weiterentwickelt, weil es neueren Experimenten widersprach. Philipp Lenard beschoss eine Alufolie mit Elektronen und stellte
fest, dass der Elektronenstrahl die Folie fast unvermindert passierte. Dies
erschien sehr verwunderlich, weil die Folie, obwohl hauchdünn, dennoch aus etwa
10000 Atomschichten bestand. Er schloss daraus, dass Atome so leer seien wie das
Weltall. Ernest Rutherford war der zweite Experimentator, der Folien mit
Teilchen beschoss. Er und Lenard sind somit die Begründer der bis heute so
erfolgreichen Methode von "Streuversuchen": Kleinste Strukturen, die mit
Mikroskopen nicht mehr erschlossen werden können, werden mit Teilchenstrahlen
"durchleuchtet". Im Innern kommt es zu Wechselwirkungen zwischen
Beschussteilchen und Atomen. Aus der Winkelverteilung der gestreuten Teilchen
kann u.a. auf die Größe geschlossen werden. Beim Rutherford-Experiment wurde ein Alpha-Strahler (![]() -Strahler) eingesetzt.
Alpha-Teichen sind schnelle Heliumkerne. Diese durchdringen mühelos eine dünne
Goldfolie und nur wenige a-Teilchen, die nahe an Kernen von Goldatomen
passieren, werden abgelenkt. Allerdings gibt es dabei eine große Überraschung:
Einige Heliumkerne werden sogar nach hinten "rückwärts gestreut". Rutherford drücke seine Verwunderung so
aus: " ... als ob man eine 15-Zoll-Granate auf Seidenpapier schießt, diese aber
zurückkehrt und den Schützen trifft". Beim Atommodell von Rutherford umkreisen
Elektronen einen winzigen Atomkern.
-Strahler) eingesetzt.
Alpha-Teichen sind schnelle Heliumkerne. Diese durchdringen mühelos eine dünne
Goldfolie und nur wenige a-Teilchen, die nahe an Kernen von Goldatomen
passieren, werden abgelenkt. Allerdings gibt es dabei eine große Überraschung:
Einige Heliumkerne werden sogar nach hinten "rückwärts gestreut". Rutherford drücke seine Verwunderung so
aus: " ... als ob man eine 15-Zoll-Granate auf Seidenpapier schießt, diese aber
zurückkehrt und den Schützen trifft". Beim Atommodell von Rutherford umkreisen
Elektronen einen winzigen Atomkern.
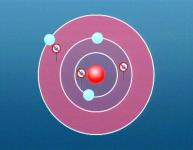
Das Atommodell mit den kreisenden Hüllenelektronen zieht sofort die nächsten
Verständnisschwierigkeiten nach sich. Die Kreisbahnen der Elektronen entsprechen
stabilen Planetenbahnen mit konstantem Radius bei denen die gegenseitige
Anziehung für die Radialkraft sorgt. Aber von der Seite gesehen, stellt ein
kreisendes Elektron eine Dipolschwingung dar, die Energie abstrahlen würde.
Damit müsste das Elektron nach klassischen Vorstellungen laufend Energie
verlieren und dann mit einer Spiralbahn in den Kern stürzen. Die neue
Verbesserung brachte Niels Bohr. Er postulierte Bahnen mit speziellen Radien, auf denen die Elektronen keine Energie
abstrahlen - dazwischen liegen verbotene Bereiche. Da mit einem bestimmten
Bahnradius eine ganz bestimmte Energie festgelegt ist, sind in einem Atom für
Hüllenelektronen nur einzelne Energiestufen möglich.
Der Frank-Hertz-Versuch
liefert dafür den Nachweis: In einer Elektronenröhre wird ein Quecksilbertropfen erhitzt und
verdampft. Elektronen, die bis zum 1.Gitter beschleunigt worden sind, werden im Bereich bis zum
2.Gitter durch eine Gegenspannung wieder abgebremst. Der Stromfluss am Anschluss
des 2.Gitters ist ein Maß für die Anzahl der Elektronen, deren Energie
ausreicht, um die Gegenspannung zu überwinden. Mit zunehmender Beschleunigungsspannung am 1.Gitter steigt der Strom zunächst
an, sinkt dann aber wieder ab. Die Erklärung benützt die Vorstellung von
Energieniveaus bei den Hüllenelektronen der Quecksilberatome. Ein Elektron der
Röhre trifft ein Hüllenelektron und überträgt dabei so viel Energie, dass dieses
das nächste Energieniveau erreicht. Anschließend kann das Röhrenelektron das
2.Gitter nicht mehr erreichen. Bei noch höheren Beschleunigungsspannungen werden
die Zyklen von ansteigendem und abfallendem Strom wiederholt. Dann kann ein
beschleunigtes Röhrenelektron nacheinander mehrere Hüllenelektronen anregen. Bei
einem zweiten Elektronenstoßversuch, diesmal mit Neongas, zeigt die Stromkurve ebenfalls einen Abfall, wenn
Hüllenelektronen die erste Energiestufe überwinden können. Angeregte Hüllenatome
geben ihre Energie anschließend in Form von Lichtblitzen einer ganz bestimmten
Frequenz und damit einer ganz bestimmten Farbe wieder ab. Bei Neon ist es ein helles Rot, bei Quecksilber
ist das Leuchten nicht sichtbar, weil es sich um ultraviolettes Licht handelt,
bei Natriumgas wäre es ein gelbes Leuchten.

Mit den Energieniveaus bei den Hüllenelektronen lassen sich auch die
Röntgenstrahlen erklären. In einer Röntgenröhre werden Elektronen so stark beschleunigt, dass sie
aus den Atome der Anode Hüllenelektronen herausschlagen. Bei sehr hohen Energien
ist es besonders wahrscheinlich, dass die Elektronen der innersten Schale
getroffen werden, die das niedrigste Energieniveau einnehmen. In die entstehende
Energielücke springt ein Hüllenelektron aus einer höheren, energiereichen Schale
und gibt dabei seine große überschüssige Energie als Lichtblitz ab. Weil die
Energiedifferenzen der inneren Schalen so groß sind, liegen die Energien und
Frequenzen der Lichtblitze weit über dem UV-Bereich und bilden die energiereiche
Röntgenstrahlung. Diese kann sogar Materie durchdringen. Im Studio wird ein Schuko-Gerätestecker durchleuchtet. Dabei treten die im Inneren
verborgenen elektrischen Anschlüsse deutlich zutage.